研究人员针对导致胰腺癌的突变
30 年来,在尝试开发药物来抑制与一些更具挑战性的癌症相关的突变蛋白方面,结果令人沮丧,但 RAS 蛋白的研究正在蓬勃发展。
MUSC Hollings 癌症中心研究员 John O'Bryan 博士表示,新发现修正了 RAS 是“不可成药”靶点或单个 RAS 突变的影响无法区分的观念。
O'Bryan 与他的长期研究伙伴、纽约大学兰格尼分校 Perlmutter 癌症中心癌症生物学主任 Shohei Koide 博士以及 Hollings 和 Perlmutter 的其他合作者一起,随着他们的发展,现在已经为这个不断增长的知识体系增添了新的内容。合成单抗体不仅附着在 KRAS(G12D)(一种在胰腺癌、肺癌和结直肠癌中常见的特定 RAS 突变)上,而且还抑制 KRAS(G12D) 的一些作用。
至关重要的是,他们用于开发单体的方法为靶向目前被认为“不可成药”的其他突变提供了蓝图。
针对 KRAS
RAS 蛋白是生化开关,调节许多生长因子和激素受体的信号传导。
“这是细胞中非常重要的信号中继,”奥布莱恩说。但突变意味着 RAS 被困在“开启”位置,导致生长失控,最终导致癌症。
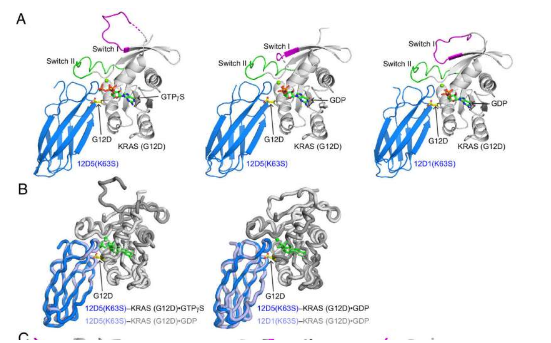
O'Bryan 和 Koide 已在 RAS 领域合作十多年。在《美国国家科学院院刊》上发表的论文中,他们报告了这些合成单体以及 KRAS(G12D)上隐藏口袋的结构,研究人员将其作为抗癌药物的秘密入口。
“当你制作一个单体时,你不知道它会做什么,”奥布莱恩解释道。“它可能只是结合而没有任何作用。但事实证明,我们针对 RAS 制造的几乎所有单体抗体都是抑制性的,这意味着它们与 RAS 功能所必需的重要区域结合。所以,首先证明它们选择性地结合并抑制 RAS,然后确定它们的结合位置,我们可以深入了解 RAS 的这些区域对于蛋白质功能的重要性。”